چالشهای درمان سرطان و ضرورت پلتفرمهای هدفمند mRNA
علیرغم پیشرفت چشمگیر درمانهای مبتنی برmRNA، انتقال این فناوری به حوزه انکولوژی با موانعی روبهرو است. نانوذرات لیپیدی متداول با ایجاد شرایط بیان خارجازهدف، بهویژه در کبد، باعث بروز سمیت و محدودشدن دوز قابلاستفاده میشوند. علاوهبراین، ریزمحیط مهاری تومور، اثربخشی mRNA را برای تحریک پاسخهای ضدتوموری کاهش میدهد. در چنین شرایطی، نیاز به سامانهای که هم تحویل انتخابی و هم ترجمه کنترلشده mRNA را تضمین کند، کاملاً محسوس است.
(TITUR (Tumour-customizable Ionizable lipids and Tumour-specific UTRs
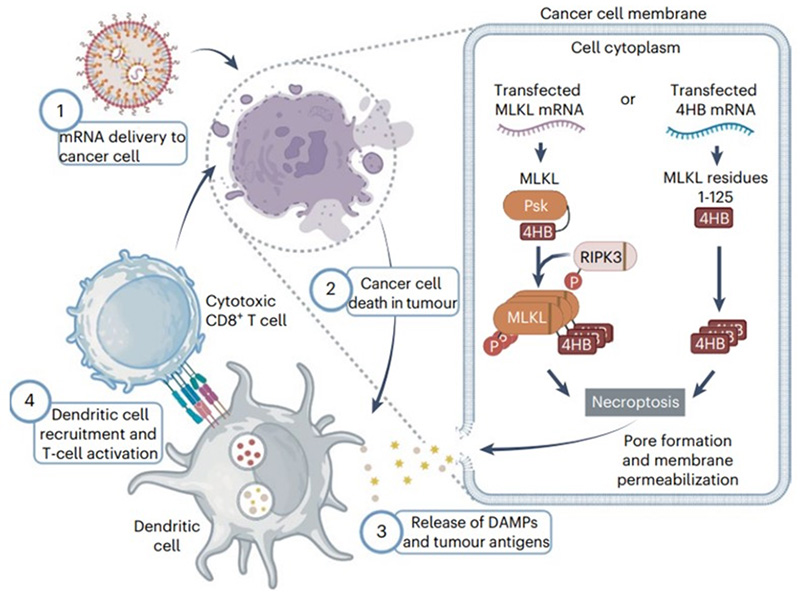
پژوهش حاضر ساختار طراحی شده TITUR را معرفی میکند که هدف آن افزایش دقت، ایمنی و کارایی درمانهای مبتنی بر mRNA در سرطان است. این پلتفرم شامل دو بخش است؛ ۱. لیپیدهای یونیزهشونده اختصاصی تومور (TIs): بر پایه یک کتابخانه ۹۶تایی از لیپیدهای طراحیشده، ترکیباتی شناسایی شدند که قادرند تحویل mRNA را در سلولهای سرطانی بهطور چشمگیری افزایش دهند. ویژگیهای ساختاری این لیپیدها موجب میشود آزادسازی mRNA عمدتاً در اندوزومهای اسیدی تومورها رخ دهد و در نتیجه بیان در کبد به حداقل برسد. این بخش “ورود انتخابی” را فراهم میکند. ۲. نواحی تنظیمی UTR حساس به miRNA(TURs): در این بخش، از تفاوت الگوی بیان miRNA میان بافتهای سالم و توموری استفاده میشود. افزودن جایگاههای اتصال برای miRNAهای فراوان در بافتهای حیاتی “مانند miR-122-5p در کبد” سبب سرکوب ترجمه در این بافتها و حفظ بیان در تومورها میشود. این بخش “خروج کنترلشده” پلتفرم را شکل میدهد و مانع بیان سمی خارجازهدف میشود. ادغام این دو لایه، تحویل و بیان mRNA را بهصورت کاملاً برنامهپذیر و اختصاصی تومور، تنظیم میکند.
ارزیابی عملکرد: القای مرگ سلولی ایمونوژنیک
برای ارزیابی کارایی TITUR،mRNA کدکننده 4HB بهعنوان یک محرک قوی مرگ سلولی ایمونوژنیک (ICD) بهکار گرفته شد. بیان هدفمند 4HB موجب افزایش کالرتیکولین سطحی، ترشح ATP و آزادسازی HMGB1 شد؛ شاخصهایی که موجب تبدیل تومورهای “سرد” به “گرم” و افزایش نفوذ سلولهای T و دندریتیک میشود. در مدلهای ملانوما، TNBC و متاستاز کبدی، این طراحی کاهش قابلتوجه رشد تومور و پروفایل ایمنیفعال را رقم زد.
چشمانداز آینده
TITUR با فراهمکردن تحویل هدفمند و ترجمه کنترلشده، بستر قدرتمند برای کاربردهای گسترده mRNAدر انکولوژی ایجاد میکند. این پلتفرم قابلیت شخصیسازی برای انواع تومورها، کاهش سمیت سیستمیک و سازگاری با ایمندرمانیها، مانند آنتی PD-1را دارد و میتواند بهعنوان نسلبعد این فناوری در نانوپزشکی سرطان مطرح میشود.
نویسنده: مهسا پویا
مرجع
https://doi.org/10.1038/s41565-025-02045-5