نویسنده: مبینا پورمرورفرد
آسیب نخاعی از اختلالات جدی عصبی است که ترمیم آن وابسته به همکاری سلولهایی مانند نورون، آستروسیت، میکروگلیا و پیشسازهای الیگودندروسیت (OPC) استOPC .ها بهدلیل توان تبدیل به نورون با بیان Sox2 و Ascl1، و نقش GDNF در بقا و بلوغ نورون، اهمیت دارند. رسانش مؤثر این سه فاکتور همچنان چالش مهمی است؛ RNA حلقوی با پایداری بالا بههمراه نانوذرات زیستسازگار، انتقال هدفمند به نخاع آسیبدیده را ممکن میسازد.
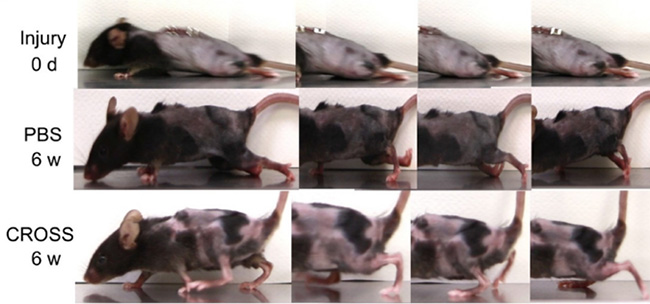
در این مطالعه، لیپیدهای زیستمقلد یونیزهشونده، شامل آمینوفوسفات، آمینوفوسفونات و آمینوفوسفوامیدات، با الهام از فسفولیپیدهای طبیعی طراحی شدند. با ترکیب RNA حلقوی و این ناقلها، سامانه انتقال درمانی CROSS ساخته شد که با انتقال موضعی حین جراحی و تزریقهای سیستمیک در هفتههای بعد از آن، نه تنها برنامهریزی مجدد سلولی و نروژنز را فعال کرد بلکه موجب بهبود قابل توجه عملکرد مثانه طی دو هفته و بهبود عملکرد حرکتی طی شش هفته شد؛ این نتایج بیانگر پتانسیل قوی سیستم CROSS به عنوان راهبرد درمانی نوین آسیب نخاعی است.
در مجموع، ۶۷ لیپید یونی مختلف تولید گردید و پس از فرمولاسیون با DOPE، کلسترول و DMG-PEG به همراه mRNA لوسیفراز، بازده انتقال به سلولهای نورونی SY5Y و آستروسیتهای اولیه آزمایش شد. هفت نانولیپید از میان ۶۷ مورد عملکرد انتقال بالایی داشتند. تحلیل ساختار عملکرد نشان داد که لیپیدهای حاوی شاخههای T5 و T8 با پیوندهای غیراشباع و شاخههای منشعب، بازده بهتری دارند. تست بقای سلولی بهترین لیپید را AP60 معرفی کرد که سمیت کمتر و زیستسازگاری بیشتری داشت. مطالعات جذب سلولی نشان داد AP60-LNP عمدتاً از طریق اندوسیتوز وابسته به کلاترین و ماکروپینوسیتوز وارد سلول میشود و تستهای فرار از اندوزوم خروج مؤثرتر آن نسبت به MC3 را اثبات کرد.
در نهایت، AP60-LNP حامل mRNA لوسیفراز بهصورت موضعی و وریدی به موش آسیب نخاعی تزریق شد. میزان بیان ژن در موشهای دریافتکننده AP60-LNP بهصورت موضعی تا ۱۳.۷ برابر و بهصورت وریدی تا ۴.۶ برابر بیشتر از گروه کنترل (MC3) بود؛ همچنین بیان ژن در کبد تا پنج برابر کاهش نشان داد.
آزمایشها نشان دادند AP60-LNP حامل RNA حلقوی علاوه بر نورونها، انتقال مؤثری به آستروسیتها، میکروگلیا و سلولهای پیشساز اولیگودندروسیت در محل ضایعه دارد. میزان بیان ژنهای درمانی( Sox2، Ascl1 و GDNF) توسط سامانه AP60 نسبت به نانوذرات مرجع MC3، تا ۳.۶ برابر برای Sox2 و ۴.۶ برابر برای Ascl1 بیشتر بود. پس از تزریق وریدی، میزان Sox2 نیز حدود دو برابر بیشتر انتقال یافته بود.
سامانه نانوذرات لیپیدی مشتق از آمینوفوسفونات با بارگذاری RNA حلقوی (CROSS)، یک رویکرد نوین و اثربخش برای درمان آسیب نخاعی است که با انتقال هدفمند فاکتورهای Sox2، Ascl1 و GDNF به بهبود عملکرد حرکتی و مثانه در مدل حیوانی منجر میشود. این فناوری با افزایش ایمنی، بازده انتقال و بیان کنترلشده ژن، بستر انعطافپذیری برای درمانهای ژنی شخصیسازیشده و داروهای عصبی نسل جدید فراهم میآورد.
مرجع
https://doi.org/10.1016/j.mattod.2025.10.005
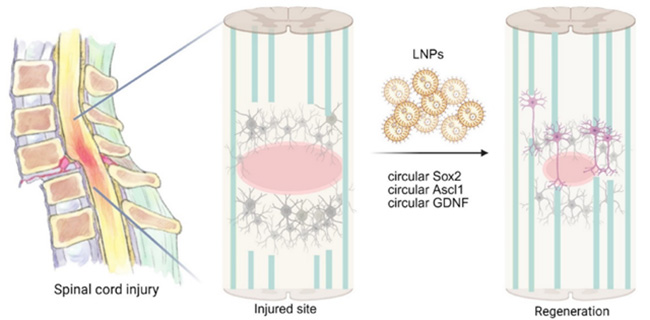

تصویر ۱: شمای کلی مطالعه
تصویر ۲: روند بهبودی در مدل آزمایشگاهی

