نویسنده: عرفان افشارمقدم
نوروفیبروماتوز نوع ۱ (NF1) یک بیماری ژنتیکی است که افراد را مستعد ابتلا به تومورهای مختلف در سراسر سیستم عصبی میکند. این تومورها میتوانند منجر به مشکلات جدی سلامتی، و حتی مرگ شوند. علت این بیماری، جهش در ژن NF1 است که پروتئینی به نام “نوروفیبرومین” را کد میکند. این پروتئین به عنوان یک سرکوبگر تومور عمل کرده و مسیر سیگنالینگ RAS را که در رشد و تقسیم سلولی نقش دارد، مهار میکند. برای ژن درمانی این بیماری اما دو چالش بزرگ وجود دارد: اول، ژن NF1 بسیار بزرگ است و در وکتورهای ویروسی استاندارد مانند ویروس مرتبط با آدنو (AAV) جای نمیگیرد. دوم، این وکتورها به طور طبیعی تمایل کمی برای هدف قرار دادن سلولهای تومور NF1 دارند.
راهکار دو بخشی پژوهشگران
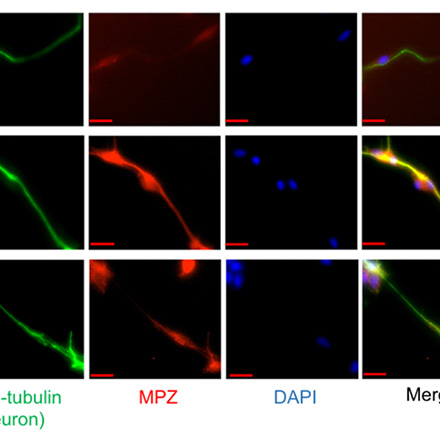
- طراحی یک ژن فشرده و کارآمد (Payload): به دلیل محدودیت ظرفیت وکتور AAV، محققان یک نسخه کوچکشده اما کاملاً کاربردی از پروتئین نوروفیبرومین ساختند. آنها بخش کلیدی این پروتئین به نام “دامنه مرتبط باGAP” یا (Gap related domain) GRD را که مسئول اصلی مهار مسیر RAS است، جدا کردند. برای افزایش کارایی، آنها این قطعه را به یک بخش کوچک از پروتئین دیگری به نام KRAS4B متصل کردند. این کار باعث شد که پروتئین کوچکشده (به نامGRDC24) مستقیماً به غشای سلولی، یعنی همان جایی که باید فعالیت خود را انجام دهد، هدایت شود. آزمایشها در مدلهای سلولی نشان داد که این پروتئین کوچکشده به طور مؤثری مسیر RAS را مهار کرده، باعث مرگ سلولهای توموری شده و توانایی سلولهای پیشساز شوان (Schwann cells) برای تمایز طبیعی را بازیابی میکند.
- مهندسی یک وکتور هدفمند (Delivery Vehicle): برای رساندن مؤثر این ژن فشرده به تومورها، پژوهشگران یک وکتور AAV اختصاصی طراحی کردند. آنها از روشی به نام “تکامل هدایتشده” استفاده کردند. در مرحله اول، با ترکیب قطعات DNA از چندین نوع AAV مختلف (تکنیکDNA shuffling)، یک کتابخانه متنوع از وکتورها ساختند و بهترین آنها را در یک مدل موشی دارای تومور NF1 شناسایی کردند. سپس، برای افزایش دقت و تمایل وکتور به تومور، یک کتابخانه پپتیدی را به سطح آن اضافه کرده و مجدداً بهترین گزینه را انتخاب کردند. نتیجه این فرآیند، یک وکتور جدید به نام AAV-NF (یا K55) بود.
نتایج و اهمیت
آزمایشهای نهایی نشان داد که وکتور AAV-NF موفقیتهای چشمگیری داشته است:
- هدفگیری دقیق: این وکتور به طور قابل توجهی تومورهای مختلف مرتبط با NF1 مانند نوروفیبروم، تومور بدخیم غلاف عصب محیطی یا MPNST و گلیومارا در مدلهای حیوانی هدف قرار داد.
- کاهش جذب کبدی: برخلاف بسیاری از وکتورهای AAV دیگر، جذب این وکتور توسط کبد بسیار کم بود که این امر ایمنی درمان را به شدت افزایش میدهد و از عوارض جانبی میکاهد.
- اثربخشی درمانی: هنگامی که این وکتور حامل ژن کوچکشده GRDC24 بود، توانست به طور مؤثری رشد تومورهای NF1 را در مدلهای موشی مهار کند.
این رویکرد نه تنها یک گزینه درمانی بالقوه برای بیماران NF1 محسوب میشود، بلکه میتواند به عنوان یک الگو برای توسعه درمانهای مشابه برای سایر بیماریهای ژنتیکی و تومورهای مرتبط با آنها مورد استفاده قرار گیرد.
مرجع
https://doi.org/10.1038/s41467-025-63619-4
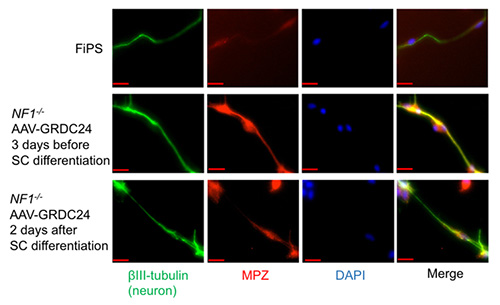
در سلولهای فاقد NF1، بیان GRDC24 تمایز سلولهای شوان را بازمیگرداند؛ نشانگر MPZ افزایش یافته و اتصال به نورونها (βIII-tubulin) بهطور طبیعی برقرار میشود.