نویسنده: عرفان افشارمقدم
ناشنوایی ارثی ناشی از جهشهای ژنتیکی، یک چالش پزشکی بزرگ است. یکی از انواع آن، ناشنوایی غیرسندرومی اتوزومال غالب ۱۵ (DFNA15) به دلیل جهش در ژن POU4F3 ایجاد میشود. این جهش معمولاً (c.337C > T) یک کدون پایان (stop codon) زودرس ایجاد میکند که منجر به تولید پروتئین ناقص، اختلال در عملکرد سلولهای مژک گوش داخلی و در نهایت ناشنوایی پیشرونده میشود. در حال حاضر هیچ درمان بالینی مؤثری برای DFNA15 وجود ندارد.
پژوهشگران ابتدا یک مدل موش (Pou4f3WT/Q113) ایجاد کردند که علائم بالینی DFNA15 انسانی، از جمله کاهش شنوایی پیشرونده پس از تولد و تخریب سلولهای مژک را شبیهسازی میکند. سپس، آنها برای تصحیح این جهش، “ویرایشگرهای باز آدنین” (ABEs) مختلفی را توسعه داده و غربالگری کردند. آنها دریافتند که ترکیبی خاص، به نام SchABE8e-sgRNA3 (شامل یک نوع Cas9 بهینهسازی شده به نام nSchCas9 و آنزیم TadA-8e) بالاترین کارایی (تا ۴۸.۵ % in vitro) و بیشترین دقت را با کمترین میزان ویرایشهای ناخواسته (bystander editing) در محل هدف دارد. از آنجایی که اندازه این ویرایشگر برای بستهبندی در یک وکتور ویروسی (AAV) بزرگ بود، محققان از یک سیستم دوگانه AAV (با سروتیپ Anc80L65 که سلولهای مژک را به خوبی آلوده میکند) استفاده کردند. در این سیستم، پروتئین SchABE8e به دو قسمت تقسیم شد و با استفاده از مکانیزم “split-intein” پس از ورود به سلول هدف، دوباره به هم متصل و فعال میشد.
تزریق این سیستم دوگانه به گوش داخلی موشهای نوزاد مبتلا (P1-3) منجر به نتایج قابل توجهی شد. ویرایش موفقیتآمیز ژن جهشیافته در سطح cDNA با میانگین ۱۴.۲% (و حداکثر ۳۰.۴%) مشاهده شد. موشهای تحت درمان، بازیابی شنوایی تقریباً کاملی (به ویژه در فرکانسهای پایین و متوسط) نشان دادند که آستانه شنوایی آنها مشابه موشهای سالم (WT) بود. این بهبودی حداقل به مدت چهار ماه پایدار ماند. علاوه بر این، درمان توانست محل قرارگیری پروتئین POU4F3 را که در اثر جهش در سیتوپلاسم گیر افتاده بود، به هسته سلول بازگرداند و همچنین منجر به حفظ و بقای بیشتر سلولهای مژک گوش داخلی در مقایسه با موشهای درماننشده گردید.
بررسیهای جامع ایمنی، از جمله توالییابی کل ژنوم (WGS) نشان داد که این روش فعالیت خارج از هدف (off-target) بسیار ناچیزی دارد. همچنین تزریق ویروس به موشهای سالم هیچگونه اثر منفی بر شنوایی، تعادل یا سلامت عمومی آنها نداشت. البته، این درمان در موشهای هموزیگوت (که هر دو نسخه ژن را معیوب داشتند) مؤثر نبود، زیرا سلولهای مژک آنها قبل از شروع درمان به طور کامل از بین رفته بود.
در مجموع، این مطالعه یک استراتژی درمانی مبتنی بر ویرایش باز in vivo را با موفقیت برای DFNA15 ارائه میدهد و پتانسیل ابزار SchABE8e را برای درمان این نوع ناشنوایی و سایر بیماریهای ژنتیکی مشابه نشان میدهد.
مرجع
https://doi.org/10.1038/s41467-025-63613-w
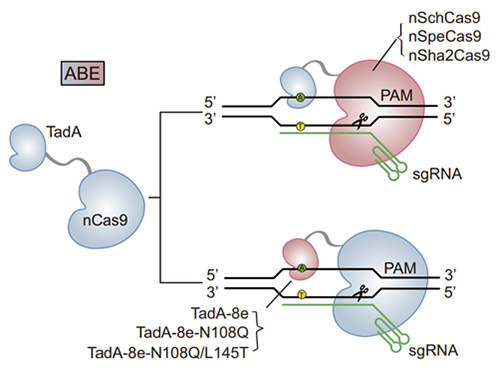
اجزاء مهم فرایند ویرایش باز در آزمایشات ژنتیکی، در این پیوهش با تغییر مهم ترین اعضا این فرایند یعنی nCas9 و TadA deaminase به بررسی عملکرد انواع مختلف این اجزا پرداخته شده است.