نویسنده: مبینا پورمرورفرد
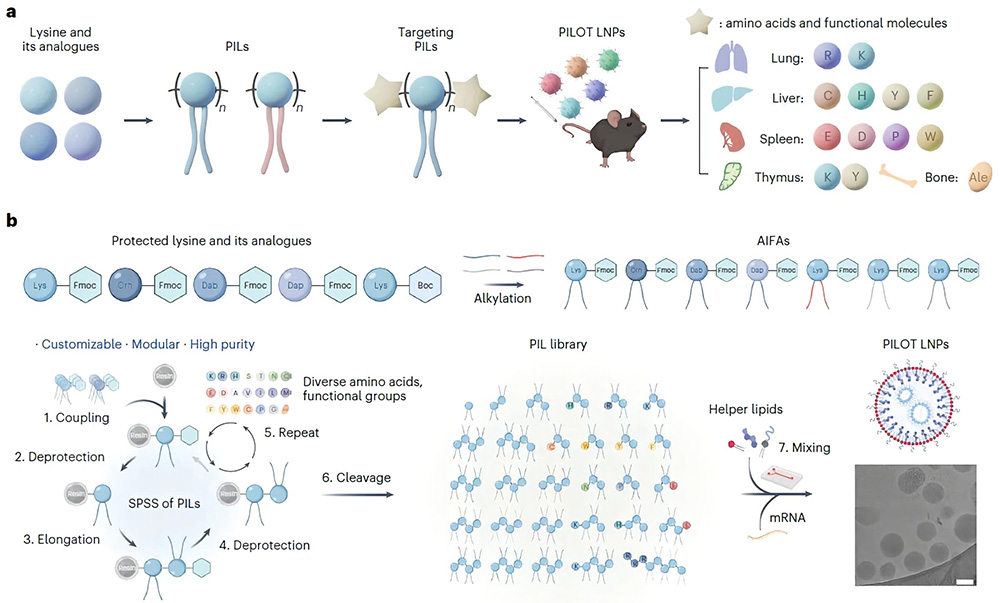
در سالهای اخیر، نانوذرات لیپیدی (LNP) مبتنی بر mRNA نقش مهمی در تحول درمانهای ژنی یافتهاند؛ اما ارسال هدفمند به اندامهای غیرکبدی و اجتناب از تجمع غیرانتخابی همچنان یک مانع محسوب میشود. پژوهش حاضر رویکردی نوین تحت عنوان PILOT را معرفی میکند که با طراحی منطقی لیپیدهای یونی–پپتیدی (PIL) بر پایه سینتیک شیمیایی و آنالیز ساختاری، امکان دارورسانی انتخابی و قابل تنظیم mRNA به اندامهایی مانند کبد، ریه، طحال، تیموس و استخوان را فراهم میسازد.
فناوری PILOT براساس ترکیب اسیدآمینههای طبیعی و گروههای یونی–مصنوعی در ساختار لیپید، به کمک سنتز solid-phase (SPSS)، بیش از ۱۲۰ ساختار مختلف Peptide Ionizable Lipid (PIL) را تولید نموده که قابلیت تنظیم گزینش اندامی در مقیاس وسیع را دارا هستند. با تغییر طول زنجیره، نوع گروه یونی، تعداد بخشهای AIFA(اسیدآمینه یونی–مصنوعی محافظتشده با Fmoc) و تعدیل گروههای پایانی، راندمان و انتخابگری انتقال به اندام هدف به طور قابل پیشبینی تغییر میکند. به عنوان مثال، ساختارهای a12Dab4 بیان ژن را در کبد تا ۱.۳۶ برابر بالاتر از نانولیپیدهای استاندارد تجاری افزایش داد و مدلهایی چون Am‑KYa12K4 و Ale‑a12K4 انتقال هدفمند mRNA به تیموس و استخوان را به ترتیب تا ۸۲٪ و ۶۲٪ ممکن ساختند.
بررسیهای مقایسهای نشان داد که راندمان انتقال mRNA توسط نانوذرات PILOT در محیط سلولی (in vitro) و بدن زنده (in vivo) به فاکتورهای متفاوتی وابسته است. در سلولهای کشتشده، نیاز به بار سطحی مثبت برای جذب و گریز از اندوزوم بیشتر است، در حالی که در بدن، پایداری بالای نانوذره، ترکیب پروتئینی سطح (کرونای پروتئینی) و ویژگیهای فوزوژنیک نقش تعیینکننده دارند. بدینترتیب، ساختارهای کمAIFA( ۱ تا ۲ واحد AIFA)در محیط آزمایشگاهی کارایی بالاتری داشته، اما ساختارهای پایدارتر و چند AIFA نظیر a12K4 و a12Dab4 عملکرد مؤثرتری در بدن زنده نشان دادند. این تفاوتها نشانگر نقش متغیرهای فیزیکوشیمیایی در سرنوشت نانوذرات طی انتقال زیستی است.
در ادامه، نانوذرات بهینه PILOT شامل ساختارهای کبدی (a12Dab4)، ریوی (Am‑Ka12K4) و طحالی (a12K4E‑Ca) با mRNAهای ویرایشگر ژن Cre و PEmax مورد آزمون قرار گرفتند. تحویل این ذرات به موشهای مدل reporter Ai9 منجر به بیان اختصاصی پروتئین فلورسانس قرمز (tdTomato) در اندامهای هدف شد، بدون نشانهای از ویرایش ژن در سایر بافتها. در کبد، ۷۴.۵٪ از هپاتوسیتها و ۴۲٪ از سلولهای کوپفر ویرایش شدند؛ در ریه، بیان اختصاصی mRNA در ۶۷٪ سلولهای اندوتلیال مشاهده گردید.
در گام بعد، سامانه ویرایش پرایم (Prime Editing) با انتقال همزمان mRNA نوع PEmax و RNA راهنما (epegRNA‑۷) بررسی شد. این ترکیب در محیط سلولی تا ۳۴٪ سلولهای HEK293T را ویرایش کرد؛ و در مدل حیوانی، پس از تزریق نانوذرات PILOT، ویرایش اختصاصی با کارایی ۱۳.۳٪ در کبد و ۷.۴٪ در ریه حاصل شد.
استراتژی منحصر بهفرد PILOT با تکیه بر سنتز مدولار و طراحی ساختاری، بستر جدیدی برای درمانهای مبتنی بر mRNA و ویرایش ژن فراهم میآورد که به طور ویژه میتواند بخش وسیعی از بیماریها و اختلالات اندامهای خاص را به طور ایمن، هدفمند و موثر پوشش دهد.
مرجع
https://doi.org/10.1038/s41563-025-02320-9