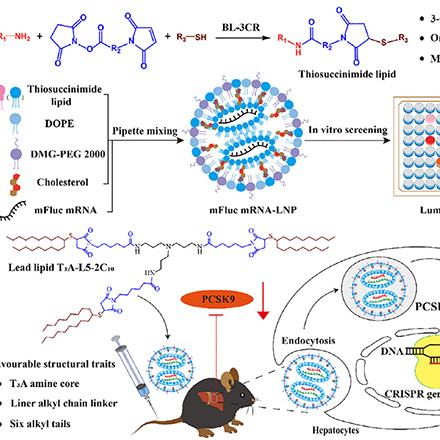
در این پژوهش، کتابخانهای ترکیبی از لیپیدهای تیوسوکسینیماید یونیزهشونده با استفاده از اتصالدهندههای دوظرفیتی (Bispecific Linker یا BL) توسعه یافت تا محدودیتهای قبلی در انتقال و بیان mRNA درمانی به سلولها و بافتهای هدف به طور مؤثری برطرف گردد. BLها نقش کلیدی و متمایز در ساختار این لیپیدها دارند؛ بهاینصورت که دو گروه واکنشپذیر مجزا را در یک مولکول فراهم میکنند (NHS ester و maleimide)، که به ترتیب با آمین و آلکیلتیول واکنش داده و تشکیل پیوند آمیدی و تیوسوکسینیمایدی میدهد. این ویژگی موجب تنوع ساختاری بالا و افزایش بازده سنتز (بیش از ۷۰٪)، بدون نیاز به کاتالیست و در زمان کوتاه، شد.
در طی غربالگری بیش از ۳۴۴ ترکیب، ساختار T3A-L5-2C10 به عنوان لیپید برتر شناخته شد. این ترکیب با دارا بودن سه گروه آمینی، اتصالدهنده آلکیل زنجیرهدار (L5) و شش زنجیره شاخهدار، انتقال mRNA لوسیفراز را در سلولهای HeLa تا ۲۲ برابر بهتر از لیپید استاندارد DLin-MC3-DMA و تا ۴۵ برابر Lipid 5 افزایش داد. آزمایشهای in vivo نشان دادند که BL آلکیلدار موجب تجمع نانوذره در کبد (liver-tropic)، در حالی که BL پگدار هدفمندی به طحال (spleen-tropic) را ایجاد میکند؛ این تفاوت با آنالیز پروتئومیک کُرونای پروتئینی سطح LNPها بهخوبی اثبات شد. آلفاپروتئین ApoE بر سطح نمونههای کبدی و GAS6 بر سطح نمونههای طحالی غالب بود که با مسیر انتقال زیستی آنها هماهنگی داشت. همچنین، تستهای حیوانی با تزریق Cas9 mRNA و sgRNA هدفمند علیه ژن PCSK9، نشان داد که T3A-L5-2C10 سبب کاهش ۸۱٪ سطح PCSK9 و ایجاد ٪۱۴.۶ جهش حذف و اضافه در ژن گردید (۶۲ برابر اثر بخش تر از لیپید مرجع)، بدون هیچگونه نشانهای از سمیت اندامی یا التهاب.
فرمولاسیون نهایی نانوذره با نسبت مولی thiosuccinimide lipid/DOPE/Chol/DMG-PEG2000 برابر ۳۵/۱۶/۴۶.۵/۲.۵، نهتنها مؤثرترین بیان ژنی را داشت، بلکه از نظر ایمنی، پایداری و عملکرد کاملاً برتر از نمونههای تجاری بود. تصویربرداری بیولومینسانس و تعیین میزان توزیع اندامی نشان داد انتقال هدفمند به کبد و سلولهای خاص با موفقیت انجام شد؛ حتی آنالیز سلولی فلوسایتومتری، بیان پروتئین فلورسنت tdTomato را منحصراً در هپاتوسیتهای کبدی یا ماکروفاژهای طحالی نشان داد که صحت هدفمندی را تأیید میکند.
در مجموع، این پژوهش نشان میدهد که با طراحی ساختار BL و انتخاب شاخهها و زنجیرههای مناسب در لیپیدهای یونی، میتوان سیستمهای انتقال mRNA را با هدفمندی اندامی تنظیم کرد و کارایی ترجمه، ایمنی و اثربخشی درمان را به شکل چشمگیری افزایش داد. این فناوری قابلیت تعمیم به درمانهای مبتنی بر mRNA، پروتئینهای ترمیمی یا ویرایش ژن در بیماریهای دژنراتیو و ژنتیکی را داراست.
نویسنده: سیده مبینا پورمرورفرد
مرجع
https://doi.org/10.1002/adhm.202502225
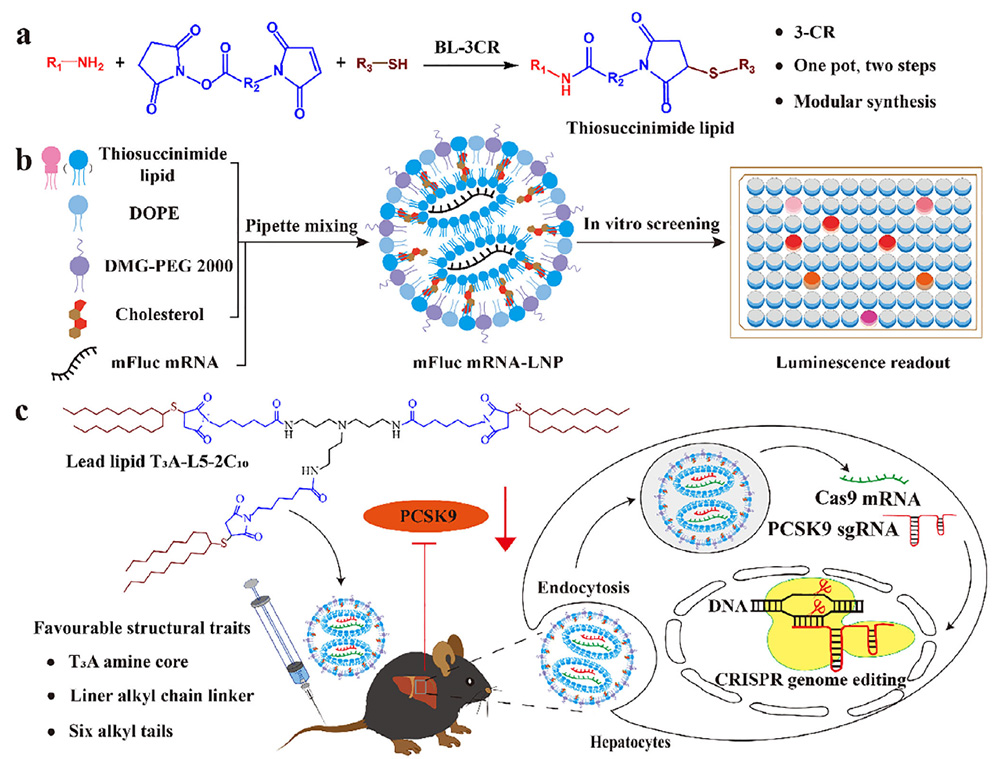
روند سنتز لیپید تیوسوکسینیماید، مراحل ساخت نانوذره هدفمند و نحوه عملکرد آن در انتقال mRNA و ویرایش ژن PCSK9 به واسطه سیستم CRISPR/Cas9
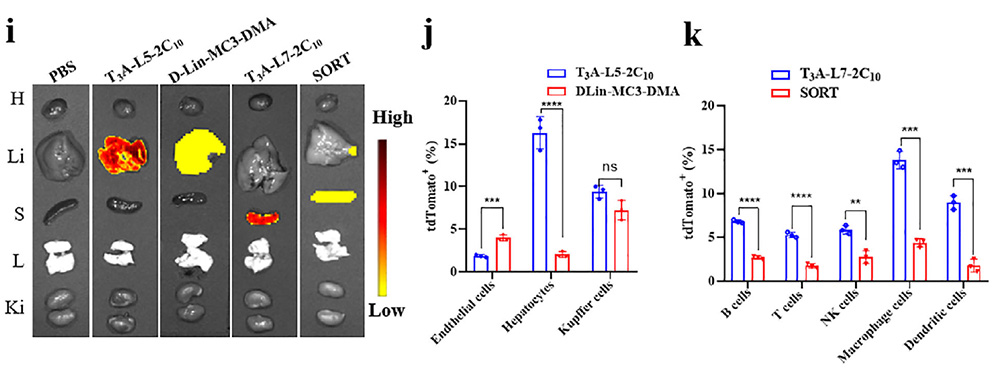
توزیع بافتی بیان پروتئین فلورسنت tdTomato پس از انتقال mRNA در مدل حیوانی