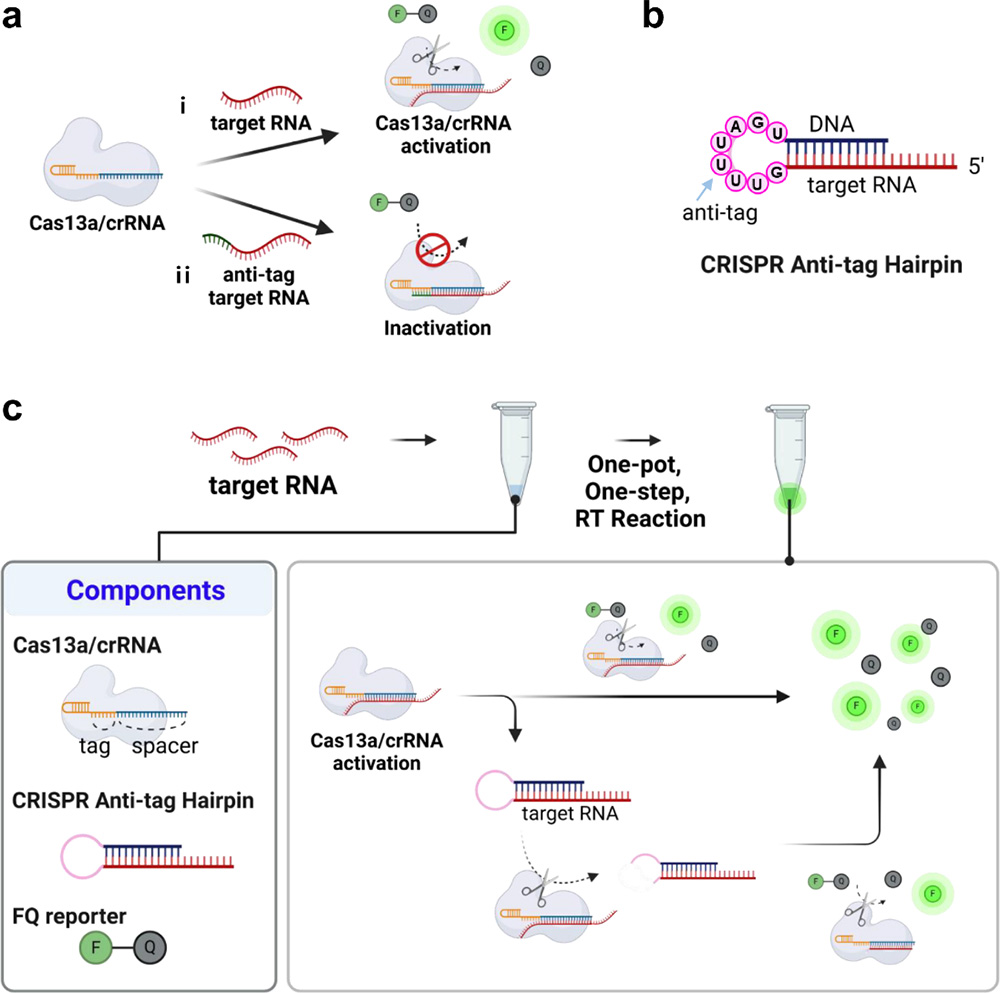
سیستم CRISPR/Cas13a به عنوان ابزاری قدرتمند برای تشخیص اختصاصی RNA ویروسها شناخته شده است اما روشهای معمول نیازمند تقویت اولیه و دمای بالای واکنش هستند که کاربرد میدانی را محدود میکند. پژوهش حاضر روش CARRD (CRISPR Anti-tag Mediated Room-temperature RNA Detection) را معرفی میکند که با استفاده از یک آنزیم Cas13a و ساختار Hairpin anti-taq، تشخیص حساس RNA ویروسهای HIV و HCV را بدون نیاز به تقویت اولیه(per-amplification) و در دمای اتاق ممکن میسازد.
در این سیستم، کمپلکس Cas13a/crRNA ابتدا RNA هدف را شناسایی میکند و با اتصال به آن تغییر کانفورماسیونی به سمت فعال شدن، فعالیت برش جانبی Cas13a صورت میگیرد. Hairpin anti-taq دارای یک توالی anti-taq در ساختار حلقه است که در غیاب RNA هدف مانع فعال شدن Cas13a میشود. درحضور RNA هدف واقعی، Cas13a فعال شده و اقدام به برش ساختار حلقه Hairpin میکند که این فرایند باعث آزادسازی توالی هدف موجود در آن و فعالیت بیشتر Cas13a میشود. این فرایند به صورت آبشاری موچب تقویت سیگنال فلورسانس خواهد شد.
واکنش با حضور سه مولفه اصلی: کمپلکس Cas13a/crRNA، Hairpin anti-taq و RNA گزارشگر دارای فلوروفور انجام میشود.
نتایج کلیدی
- حساسیت تشخیص در دامنه ۱۰ آتمولار (۱۰^-۱⁸ مولار)، که نسبت به روشهای مرسوم Cas13a ۱۰,۰۰۰ برابر بهبود یافته است.
- قابلیت عملکرد در دمای اتاق (حدود ۲۵ درجه سانتیگراد) بدون نیاز به تجهیزات گرمایشی و تقویت اولیه.
- طراحی بهینه hairpin با بلوکرهای DNA ۱۴ نوکلئوتیدی که بالاترین تقویت سیگنال را فراهم میکند.
- قابلیت تشخیص اختصاصی انواع RNA ویروسهای HIV و HCV بدون تداخل و نتایج قابل اطمینان در نمونههای بالینی.
آزمایش بالینی
پژوهشگران با CARRD موفق به شناسایی RNA ویروس HIV در ۳۰ نمونه پلاسمای کلینیکی شدند. مقایسه نتایج با RT-qPCR سنتی نشاندهنده حساسیت ۷۷.۸٪، اختصاصیت ۱۰۰٪ و دقت کلی ۹۳.۳٪ است. نمودارهای ROC تایید عملکرد بسیار بالای روش را نشان داد.
اهمیت تکنولوژیک
روش CARRD با حذف مراحل پیچیده و زمانبر تقویت اولیه و تجهیزات گرمایشی، امکان تشخیص سریع، حساس و مقرونبهصرفه RNA ویروس را با صرفهجویی در هزینه و گسترش حوزه های کاربرد فراهم میآورد. ساختار Hairpin anti-taq طراحی شده، مانع سیگنال پسزمینه شده و با فعال شدن در حضور توالی هدف، سیگنال را به شکل آبشاری تقویت میکند. این رویکرد ساده و قدرتمند ضمن بهبود عملکرد حتی با یک آنزیم Cas13a امکان توسعه ابزارهای تشخیصی برای تشخیص در محل ارائه خدمت (Point-of-care)و محیطهای با منابع محدود را فراهم میکند.
چشمانداز
پژوهشگران تأکید میکنند که بهینهسازی بیشتر در طراحی hairpin و crRNA، استفاده از روشهای خوانش قابل حمل و گسترش به دیگر ویروسها میتواند کاربردهای بالینی و تشخیصی این فناوری را افزایش دهد.
نویسنده: سمیه امیدی
مرجع
https://doi.org/10.1038/s41467-025-64205-4