ایمنیدرمانی مبتنی بر آنتیبادیهای مهارکننده نقاط کنترل ایمنی (immune checkpoint inhibitors, ICIs) نظیر مهارکنندههای PD-1 و CTLA-4 طی یک دهه گذشته به یکی از ارکان درمان سرطان تبدیل شده و در بسیاری از بیماران منجر به پاسخهای پایدار شده است. با این حال، یکی از بزرگترین چالشهای این رویکرد، بروز مقاومت اولیه یا اکتسابی در بعضی از بیماران است.
یکی از مکانیسمهای شناخته شده این مقاومت، اختلال در مسیر ارائه آنتیژن به ویژه به دلیل از دست رفتن یا غیرفعال شدن مولکولهای MHC کلاس I است که معمولاً ناشی با تغییرات ژنتیکی در ژن β۲-میکروگلوبولین (B2M) رخ میدهد. در چنین شرایطی، سلولهای توموری قادر به ارائه آنتیژن به لنفوسیتهای T سایتوتوکسیک نیستند و بنابراین حتی در حضور مهارکنندههای PD-1 یا CTLA-4 نیز پاسخ ضد توموری قوی شکل نمیگیرد. این مسئله یکی از دلایل مهم شکست ایمنیدرمانی در بیماران مبتلا به سرطانهای پیشرفته به شمار میرود.
تزریق درون توموری نانو ذرات لیپیدی حاوی mRNA کدکننده IL-12 با کنار زدن این نقطه ضعف، میتواند مسیرهای جایگزین ایمنی را فعال ساخته و محدودیت ناشی از نقص ارائه آنتیژن را جبران نماید. تولید موضعی IL-12 در بافت تومور باعث افزایش چشمگیر بیان سایتوکاینهای تیپ Th1 از جمله IFN-γ و TNF-α و همچنین کموکاینهایی نظیر CXCL9، CXCL10، CCL2 و CCL5 میشود که این تغییرات منجر به جذب و نگهداری مؤثر سلولهای T سایتوتوکسیک و ماکروفاژهای فعال در عمق بافت تومور میشود.
یافته ها
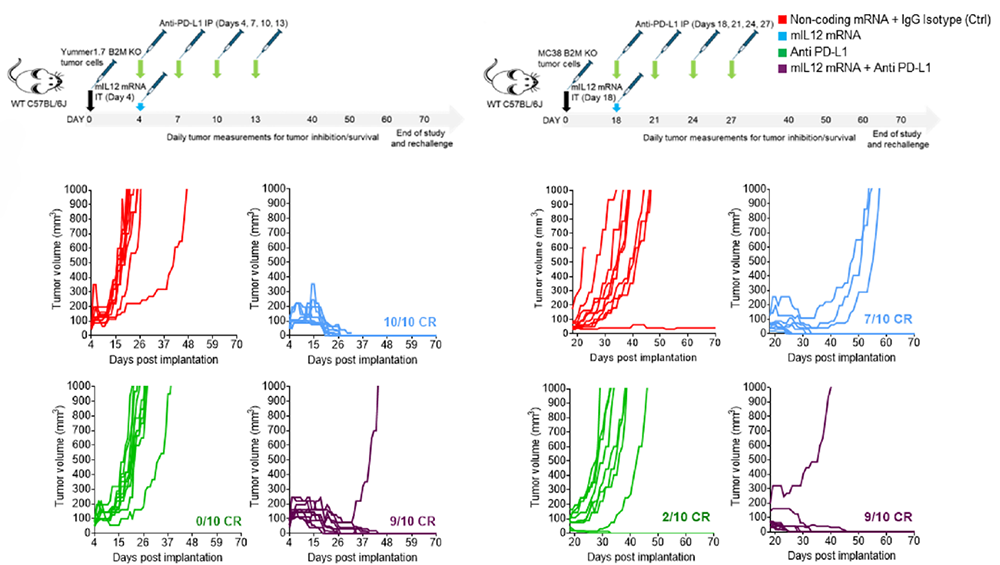
نتایج این مطالعه نشان میدهد که تزریق درون توموری mRNA کدکننده IL-12 در مدلهای مختلف توموری حساس و مقاوم به مهارکنندههای نقاط کنترل ایمنی، قادر است پاسخهای ضد توموری قدرتمندی ایجاد کند. در مدل ملانومای Yummer B2M KO که فاقد بیان MHC-I است، تمامی حیوانات تحت درمان (۱۰ از ۱۰ مورد) به پاسخ کامل دست یافتند. در مدل کولورکتال MC38 B2M KO نیز ۷۰ درصد پاسخ کامل و ۳۰ درصد پاسخ جزئی مشاهده شد. این نتایج نشان میدهد که حتی در غیاب ارائه آنتیژن از طریق MHC-I، mRNA کدکننده IL-12 به تنهایی توانسته است اثرات ضد توموری برجستهای ایجاد کند؛ در حالی که ترکیب آن با آنتی PD-L1 تنها به افزایش اندک اثربخشی منجر شد.
موشهایی که به درمان پاسخ کامل نشان داده بودند، حتی پس از بازچالش با تعداد دو برابر سلولهای توموری، دچار عود نشدند که بیانگر دوام پاسخها و شکلگیری یک پاسخ ایمنی حافظهای سیستمیک است.
تحلیل ریزمحیط تومور نشان میدهد که درمان با mRNA کدکننده IL-12 موجب افزایش بیش از سه برابری سلولهای T سیتوتوکسیک CD8+ و جمعیت ماکروفاژهای فعال (MHCII+CD38+) نسبت به گروه کنترل میشود. این تغییرات به ویژه در مدل Yummer B2M KO برجستهتر است و با نفوذ عمیق سلولهای T به مرکز تومور همراه میشود.
نتیجهگیری
این یافتهها چشمانداز تازهای برای درمان بیماران مبتلا به تومورهای مقاوم به نقاط کنترل ایمنی فراهم میکند و تزریق درون توموری mRNA کدکننده IL-12 میتواند بهعنوان یک پلتفرم درمانی مستقل یا در ترکیب با سایر روشهای ایمنیدرمانی در آینده به کار گرفته شود.
مرجع
https://doi.org/10.1007/s00262-025-04105-0
شرح تصویر: تزریق مستقل mRNA کدکننده IL-12 و ترکیب آن با آنتی PD-L1 منجر به پاسخ ایمنی کامل در تومورهای مقاوم به مهارکننده های نقاط کنترل ایمنی ملانوما(تصویر چپ) و کولورکتال(تصویر راست) میشود.